守护大脑的“隐形高手”:燕窝酸

Part 01
【不止DHA,大脑同样需要燕窝酸】
【不止DHA,大脑同样需要燕窝酸】
燕窝酸以一种与DHA完全不同的机制
支持着我们一生的大脑发育与神经健康
但鲜为人知的是,大脑发育还有一位“隐形高手”——燕窝酸(Sialic-Acid,又称唾液酸,简称SA)。研究发现,燕窝酸以一种与DHA完全不同的机制,支持着我们一生的大脑发育与神经健康。
Part02
【什么是燕窝酸?】
【什么是燕窝酸?】
人类大脑中燕窝酸的含量是其他哺乳动物的2-4倍
这是人类认知能力突出的重要原因之一
什么是燕窝酸?
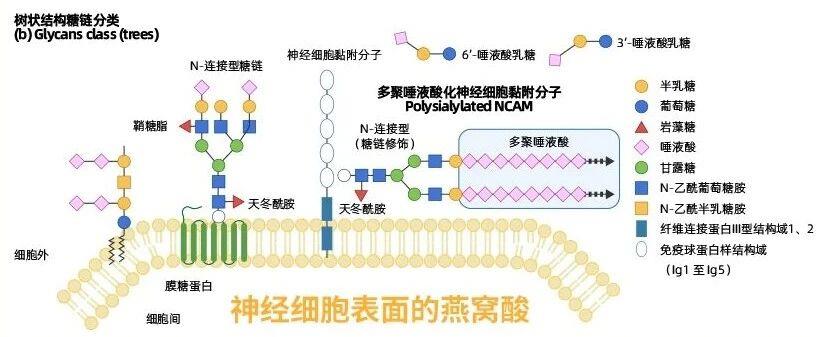
燕窝酸,学名N-乙酰神经氨酸,是一种九碳酸性单糖,在大脑(尤其是大脑灰质)和母乳中含量丰富。研究表明,人类大脑中燕窝酸的含量是其他哺乳动物的2-4倍[2],这是人类认知能力突出的重要原因之一。燕窝酸作为糖缀合物(如糖蛋白、神经节苷脂)的末端糖基,直接参与细胞识别、粘附、信号转导等关键生物学过程[3]。
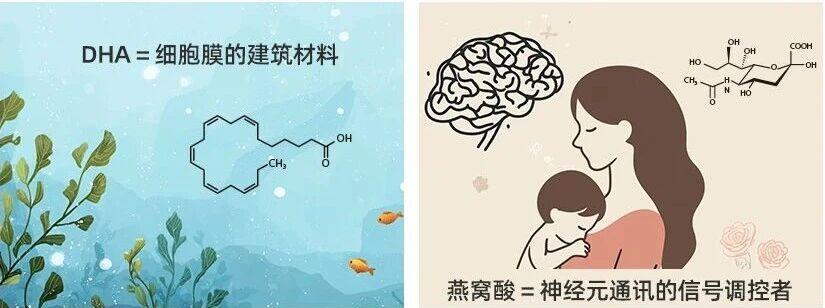
燕窝酸与DHA有何不同?

DHA与燕窝酸在大脑健康中扮演着截然不同但同等重要的角色。DHA如同神经细胞的“建筑材料”,负责构建细胞膜的基本结构,为神经信号传导提供稳定的 “通道”。
燕窝酸则更像是神经细胞间的 “信号调度员”,它附着在神经细胞表面的糖蛋白和神经节苷脂上,精准指导细胞间的沟通与连接。
如果把神经细胞比作通讯塔,DHA就是塔的钢筋结构,保证塔的稳固;燕窝酸则是塔顶的 “信号接收器”,帮助神经信号更精准地传递,还能帮助新生的神经细胞顺利“组网”。
为何燕窝酸知名度不高?

Part03
【大脑发育四大阶段都需要燕窝酸】
这位“隐藏高手”究竟
在我们生命的不同阶段扮演着怎样的角色呢
【大脑发育四大阶段都需要燕窝酸】
这位“隐藏高手”究竟
在我们生命的不同阶段扮演着怎样的角色呢
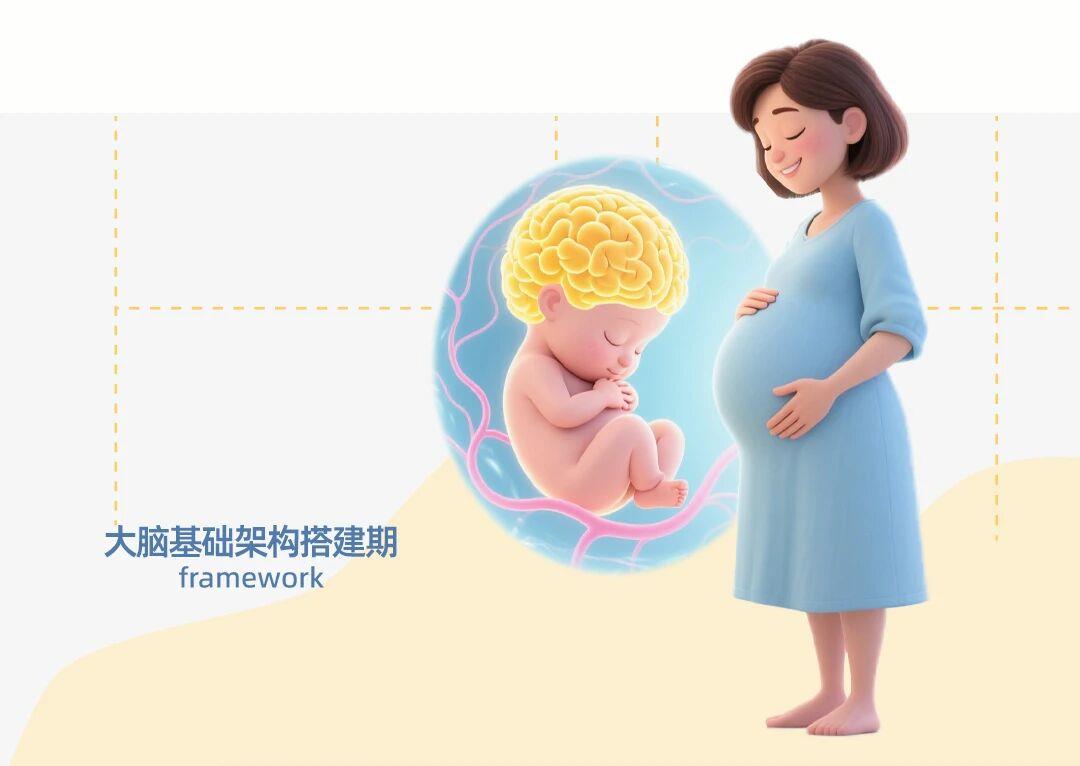
胎儿期是大脑发育最迅速的阶段,包括神经管形成、神经元大量增殖和迁移。此时,大脑需要大量基础材料构建基本结构。燕窝酸通过胎盘从母体传递给胎儿,成为神经细胞表面糖链的重要组成部分,直接参与神经嵴细胞迁移和突触初步形成[4,5]。研究显示,孕妇血清中燕窝酸水平随孕周增加而显著上升,从孕早期的1.388 mmol/L上升到孕晚期的1.712 mmol/L[6],提高了23%,这充分反映了胎儿对燕窝酸的需求不断增加。

婴幼儿期:突触爆发式增长期
出生后0-3年是大脑突触形成的关键期,突触数量可达成人的两倍。突触的核心功能是控制神经信号在细胞间的定向传递,它是神经系统实现复杂功能,如思维、情感、学习、记忆的结构和功能基础。这一时期,燕窝酸作为神经节苷脂的核心成分,直接参与突触形成和功能维持。
母乳中含有丰富的母乳低聚糖(HMOs),其中约14%-33%是唾液酸化低聚糖(如3′-SL和6′-SL),是自然界中燕窝酸最丰富的来源。需要说明的是,这些“唾液酸化低聚糖”进入人体后,有两种主要的利用方式:一方面,少量会以完整的寡糖形式被吸收,在体内更多发挥信号调控和免疫调节的作用,比如作为“抗粘附分子”,阻止有害病菌粘在肠道壁上;另一方面,更主要的作用是它们会被分解,释放出游离态的燕窝酸。这种“自由的燕窝酸”才是机体真正利用的关键原料,它会被用来合成神经节苷脂和糖蛋白(支持神经发育和突触可塑性),合成黏蛋白(维护肠道屏障),以及参与免疫系统的调控(通过糖链修饰来实现)。值得注意的是,燕窝酸在初乳中浓度高达1500 mg/L,成熟乳中也有200-300 mg/L;而普通配方奶中含量仅为70-288 mg/L[7]。
研究证实,母乳喂养婴儿唾液中的燕窝酸水平比配方奶喂养婴儿高出近50%[8],是促进其神经网络精细化发育的一个重要因素。另一项研究表明,母乳喂养的婴儿大脑中神经节苷脂和糖蛋白结合的燕窝酸含量也显著升高[9]。

儿童青少年期:神经网络优化期
这一时期,是大脑发育的黄金窗口。大脑进入"精修"阶段,不必要的突触被剔除,高效神经网络被保留。燕窝酸是合成多聚唾液酸(PSA) 的前体,而PSA对神经细胞粘附分子(NCAM)的修饰作用,在维持神经回路可塑性中扮演重要角色[10]。所谓“神经回路可塑性”,可以简单理解为大脑像是一张会不断调整的“电路图”,它能根据学习和经历来加强有用的连接、削弱无用的连接。神经回路越灵活、越可塑,大脑学习新知识和形成记忆的能力就越强。
研究发现,PSA-NCAM在调节海马体长期增强(LTP)中起关键作用,而LTP正是学习记忆的细胞基础[10,11]。海马体是大脑边缘系统中的关键结构,就像是“大脑的学习中枢”和“记忆加工厂”,不仅负责把短期记忆转化为长期记忆,还参与空间导航(比如记住路线)和情绪调节。动物实验表明,成年大鼠补充富含燕窝酸的低聚糖能促进大脑合成富含燕窝酸的分子并明显改善学习能力[12]。
由此可知,在儿童青少年期,燕窝酸是支持大脑神经结构发育、增强神经可塑性的重要营养素,科学补充燕窝酸有助于增强学生学习和记忆能力。

中老年期:神经维护期
神经退行性疾病是一类大脑神经元功能逐渐丧失的疾病,其中最常见的是阿尔茨海默病(AD),多发病于中老年期,它会导致人的记忆、思维和行为能力进行性下降。研究表明,AD确诊后患者平均生存期为4至8年,并且该病在现代社会有发病年龄提前的趋势,且已成为全球范围内的前十大死因之一[13]。
随着年龄增长,大脑燕窝酸含量自然下降。阿尔茨海默病(AD)患者脑中神经节苷脂GM1、GD1a等含燕窝酸的结构显著减少[14]。补充外源性燕窝酸可能通过多种途径减缓衰退:维持神经细胞表面受体功能、减少淀粉样蛋白毒性、增强神经可塑性[15,16]。
临床研究显示,GM1神经节苷脂治疗可改善脑卒中患者的神经功能恢复[16,17],这为燕窝酸在神经退行性疾病的应用提供了证据。
Part04
【燕窝酸的相关验证】
目前燕窝酸益处的研究正从动物实验和体外研究
逐步延伸至人体临床试验
大量科学研究证实,母乳喂养不仅能提升儿童期的认知表现,更与长期的智力发展、教育成就乃至经济收入呈正相关,其中母乳特有的活性成分可能是关键因素。样本量超过13,000名儿童的研究发现,母乳喂养的儿童在6.5岁时表现出更高的言语智商(+7.5分)和总智商(+5.9分)[18]。Horta 团队对36项研究的荟萃分析发现,母乳喂养的孩子IQ平均分比配方奶喂养的高2.62分,语言能力尤其突出[19]。
更深入的研究显示,母乳喂养的早产儿到15岁时,大脑白质体积更大,研究者分析,母乳中高含量的燕窝酸可能在其中发挥了关键作用,它们能穿过血脑屏障,通过调节细胞表面功能、促进细胞间连接,间接参与神经细胞构建[20]。长达30年的追踪研究证实,母乳喂养组在智商、教育水平和收入方面都显示出持续优势[21]。尽管这些观察性研究难以排除其他混杂因素,但多项大型研究得出的一致结论,强烈提示母乳中的燕窝酸等活性成分在其中发挥了关键作用。
燕窝酸可增强海马体的突触可塑性,突触可塑性是学习和记忆的生物学基础,与学习能力、记忆力等认知效应直接相关。补充830mg/L燕窝酸的猪仔在复杂迷宫学习中表现更佳,尝试次数显著减少,同时海马体中燕窝酸合成相关基因(Gne和ST8Sia IV)表达上调2-3倍[22]。小鼠实验中,补充6'-SL显著增强长期记忆能力,改善海马体突触可塑性[11]。
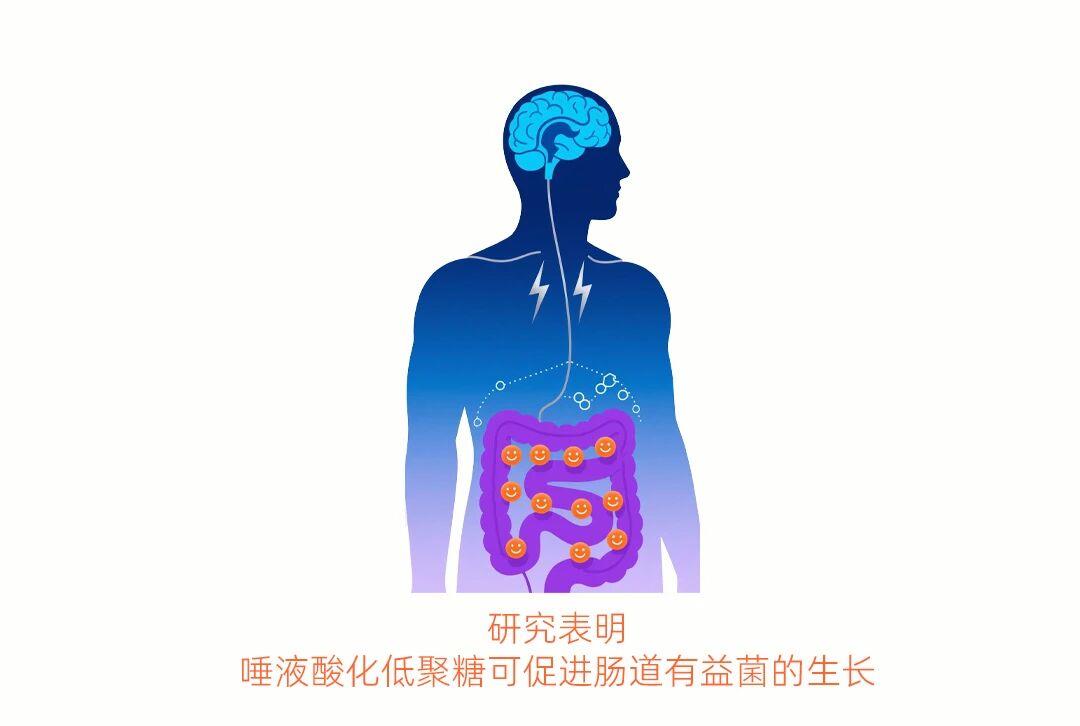

脑肠轴是大脑和肠道之间一个双向通信网络,它连接了大脑的情感、认知中枢与肠道的消化、免疫和内分泌功能。肠道微生物是肠脑轴中的一个关键环节[23]。
研究发现,含燕窝酸的低聚糖能通过"脑肠轴"调节肠道菌群,间接影响大脑功能。摄入3′-SL和6′-SL(含燕窝酸的低聚糖)的小鼠在应激条件下表现出更少的焦虑行为,同时肠道微生物组成也发生有益变化。这些含燕窝酸的低聚糖可能通过促进双歧杆菌等有益菌生长,其代谢产物通过免疫、神经(如迷走神经)、内分泌或代谢途径向大脑发送“安心”信号,从而调节应激反应和情绪[23,24]。
总结与展望
选择母乳喂养、关注营养成分、科学补充燕窝酸,是对大脑健康的长远投资。需要注意的是,目前大多数关于燕窝酸益处的强力证据仍来自动物实验和体外研究。高质量的人体临床试验仍在不断积累中,这是未来研究的重要方向。随着研究的不断深入,燕窝酸有望在神经营养领域发挥更加重要的作用,为各年龄段人群的脑健康提供新的解决方案。
参考文献
[1] Lauritzen, L., Brambilla, P., Mazzocchi, A., Harsløf, L. B., Ciappolino, V., & Agostoni, C. (2016). DHA effects in brain development and function. Nutrients, 8 (1), 6.
[2] Wang, B., Brand-Miller, J., McNeil, Y., & McVeagh, P. (1998). Sialic acid concentration of brain gangliosides: Variation among eight mammalian species. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 119 (1), 435-439.
[3] Wang, B., & Brand-Miller, J. (2003). The role and potential of sialic acid in human nutrition. European Journal of Clinical Nutrition, 57 (11), 1351-1369.
[4] Briese, V., Kunkel, S., Plath, C., Wutzke, K., & Plesse, R. (1999). Sialic acid, steroids and proteohormones in maternal, cord and retroplacental blood. Zeitschrift für Geburtshilfe und Neonatologie, 203, 63-68.
[5] Schnaar, R. L., Gerardy-Schahn, R., & Hildebrandt, H. (2014). Sialic acids in the brain: gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration. Physiological Reviews, 94 (2), 461-518.
[6] Chhabra, R. J., Singh, S., Mangukiya, K., & Gorasiya, J. (2015). A study of circulating sialic acid levels in pregnancy. The Journal of Medical Research, 1 (4), 126-128.
[7] Wang, B., Brand-Miller, J., McVeagh, P., & Petocz, P. (2001). Concentration and distribution of sialic acid in human milk and infant formulas. The American Journal of Clinical Nutrition, 74 (4), 510-515.
[8] Tram, T. H., Brand-Miller, J. C., McNeil, Y., & McVeagh, P. (1997). Sialic acid content of infant saliva: Comparison of breast fed with formula fed infants. Archives of Disease in Childhood, 77 (4), 315-318.
[9] Wang, B., McVeagh, P., Petocz, P., & Brand-Miller, J. (2003). Brain ganglioside and glycoprotein sialic acid in breastfed compared with formula-fed infants. The American Journal of Clinical Nutrition, 78 (5), 1024-1029.
[10] Rutishauser, U. (2008). Polysialic acid in the plasticity of the developing and adult vertebrate nervous system. Nature Reviews Neuroscience, 9 (1), 26-35.
[11] Oliveros, E., Vázquez, E., Barranco, A., Ramírez, M., Gruart, A., Delgado-García, J. M., Buck, R., Rueda, R., & Martín, M. J. (2018). Sialic acid and sialylated oligosaccharide supplementation during lactation improves learning and memory in rats. Nutrients, 10 (10), 1519.
[12] Sakai, F., Ikeuchi, Y., Urashima, T., Fujihara, M., Ohtsuki, K., & Yanahira, S. (2006). Effects of feeding sialyllactose and galactosylated N-acetylneuraminic acid on swimming learning ability and brain lipid composition in adult rats. Journal of Applied Glycoscience, 53 (4), 249-254.
[13] Institute for Health Metrics and Evaluation (IHME). (2024). Global Burden of Disease Study 2024.
[14] Fukami, Y., Ariga, T., Yamada, M., & Yuki, N. (2017). Brain gangliosides in Alzheimer's disease: Increased expression of cholinergic neuron-specific gangliosides. Current Alzheimer Research, 14 (6), 586-591.
[15] Magistretti, P. J., Geisler, F. H., Schneider, J. S., Li, P. A., Fiumelli, H., & Sipione, S. (2019). Gangliosides: Treatment avenues in neurodegenerative disease. Frontiers in Neurology, 10, 859.
[16] Fazzari, M., Lunghi, G., Chiricozzi, E., Mauri, L., & Sonnino, S. (2022). Gangliosides and the treatment of neurodegenerative diseases: A long Italian tradition. Biomedicines, 10 (2), 363.
[17] Lenzi, G. L., Grigoletto, F., Gent, M., Roberts, R. S., Walker, M. D., Easton, J. D., Carolei, A., Dorsey, F. C., Rocca, W. A., & Bruno, R. (1994). Early treatment of stroke with monosialoganglioside GM-1. Efficacy and safety results of the Early Stroke Trial. Stroke, 25 (8), 1552-1558.
[18] Kramer, M. S., Aboud, F., Mironova, E., Vanilovich, I., Platt, R. W., Matush, L., Igumnov, S., Fombonne, E., Bogdanovich, N., Ducruet, T., et al. (2008). Breastfeeding and child cognitive development: New evidence from a large randomized trial. Archives of General Psychiatry, 65 (5), 578-584.
[19] Horta, B. L., Loret de Mola, C., & Victora, C. G. (2015). Breastfeeding and intelligence: a systematic review and meta-analysis. Acta Paediatrica, 104 (467), 14-19.
[20] Isaacs, E. B., Fischl, B. R., Quinn, B. T., Chong, W. K., Gadian, D. G., & Lucas, A. (2010). Impact of breast milk on intelligence quotient, brain size, and white matter development. Pediatric Research, 67 (4), 357-362.
[21] Victora, C. G., Horta, B. L., de Mola, C. L., Quevedo, L., Pinheiro, R. T., Gigante, D. P., Gonçalves, H., & Barros, F. C. (2015). Association between breastfeeding and intelligence, educational attainment, and income at 30 years of age: a prospective birth cohort study from Brazil. The Lancet Global Health, 3 (4), e199-e205.
[22] Wang, B., Yu, B., Karim, M., Hu, H., Sun, Y., McGreevy, P., Petocz, P., Held, S., & Brand-Miller, J. (2007). Dietary sialic acid supplementation improves learning and memory in piglets. The American Journal of Clinical Nutrition, 85 (2), 561-569.
[23] Gao, W., Baumgartel, K. L., & Alexander, S. A. (2020). The gut microbiome as a component of the gut-brain axis in cognitive health. Biological Research for Nursing, 22 (4), 485-494.
[24] Tarr, A. J., Galley, J. D., Fisher, S. E., Chichlowski, M., Berg, B. M., & Bailey, M. T. (2015). The prebiotics 3'Sialyllactose and 6'Sialyllactose diminish stressor-induced anxiety-like behavior and colonic microbiota alterations: Evidence for effects on the gut-brain axis. Brain, Behavior, and Immunity, 50, 166-177.
凯幸生物®原创科普工程 | 每一行文字都经过科学审核与文献验证。
转载请注明原始出处并保留此声明,您对出处的每一次标注,都是对科研工作者辛勤付出的尊重。©KansenBio




 TOP
TOP